Ghép phổi là phương pháp điều trị được chấp nhận cho bệnh phổi tiến triển. Trong vài thập kỷ qua, ghép phổi đã đạt được những tiến bộ đáng kể trong việc sàng lọc và đánh giá người nhận ghép, lựa chọn, bảo quản và phân bổ phổi của người hiến tặng, kỹ thuật phẫu thuật, quản lý hậu phẫu, quản lý biến chứng và ức chế miễn dịch.
Trong hơn 60 năm qua, ghép phổi đã phát triển từ một phương pháp điều trị thử nghiệm thành phương pháp điều trị tiêu chuẩn được chấp nhận cho các bệnh phổi đe dọa tính mạng. Bất chấp những vấn đề thường gặp như rối loạn chức năng ghép nguyên phát, rối loạn chức năng phổi sau ghép mạn tính (CLAD), nguy cơ nhiễm trùng cơ hội cao, ung thư và các vấn đề sức khỏe mãn tính liên quan đến ức chế miễn dịch, việc lựa chọn đúng người nhận hứa hẹn sẽ cải thiện tỷ lệ sống sót và chất lượng cuộc sống của bệnh nhân. Mặc dù ghép phổi đang ngày càng phổ biến trên toàn thế giới, số lượng ca phẫu thuật vẫn chưa theo kịp nhu cầu ngày càng tăng. Bài đánh giá này tập trung vào tình hình hiện tại và những tiến bộ gần đây trong ghép phổi, cũng như các cơ hội trong tương lai để triển khai hiệu quả liệu pháp đầy thách thức nhưng có khả năng thay đổi cuộc sống này.
Đánh giá và lựa chọn người nhận tiềm năng
Do phổi hiến tặng phù hợp tương đối khan hiếm, các trung tâm ghép tạng có nghĩa vụ đạo đức phải phân bổ nội tạng hiến tặng cho những người nhận tiềm năng có nhiều khả năng nhận được lợi ích ròng từ việc ghép tạng. Định nghĩa truyền thống về những người nhận tiềm năng này là họ có nguy cơ tử vong do bệnh phổi ước tính cao hơn 50% trong vòng 2 năm và có cơ hội sống sót cao hơn 80% sau 5 năm ghép, giả định rằng phổi được ghép hoạt động hoàn toàn bình thường. Các chỉ định ghép phổi phổ biến nhất là xơ phổi, bệnh phổi tắc nghẽn mạn tính, bệnh mạch máu phổi và xơ nang. Bệnh nhân được chuyển tuyến dựa trên tình trạng suy giảm chức năng phổi, suy giảm chức năng thể chất và tiến triển của bệnh mặc dù đã sử dụng tối đa thuốc và liệu pháp phẫu thuật; Các tiêu chí cụ thể khác về bệnh cũng được xem xét. Những thách thức về tiên lượng hỗ trợ các chiến lược chuyển tuyến sớm, cho phép tư vấn rủi ro-lợi ích tốt hơn để cải thiện việc ra quyết định chung sáng suốt và cơ hội thay đổi các rào cản tiềm ẩn đối với kết quả ghép tạng thành công. Nhóm đa chuyên khoa sẽ đánh giá nhu cầu ghép phổi và nguy cơ biến chứng sau ghép của bệnh nhân do sử dụng thuốc ức chế miễn dịch, chẳng hạn như nguy cơ nhiễm trùng có khả năng đe dọa tính mạng. Việc sàng lọc rối loạn chức năng cơ quan ngoài phổi, thể lực, sức khỏe tâm thần, miễn dịch toàn thân và ung thư là rất quan trọng. Việc đánh giá cụ thể các động mạch vành và não, chức năng thận, sức khỏe xương, chức năng thực quản, năng lực tâm lý xã hội và hỗ trợ xã hội là rất quan trọng, đồng thời cần thận trọng để duy trì tính minh bạch nhằm tránh bất bình đẳng trong việc xác định khả năng ghép tạng.
Nhiều yếu tố nguy cơ gây hại nhiều hơn các yếu tố nguy cơ đơn lẻ. Các rào cản truyền thống đối với ghép tạng bao gồm tuổi cao, béo phì, tiền sử ung thư, bệnh hiểm nghèo và bệnh toàn thân đi kèm, nhưng những yếu tố này gần đây đã bị thách thức. Độ tuổi của người nhận đang tăng đều đặn, và đến năm 2021, 34% người nhận ở Hoa Kỳ sẽ trên 65 tuổi, cho thấy sự chú trọng ngày càng tăng vào tuổi sinh học hơn là tuổi theo thời gian. Hiện nay, ngoài khoảng cách đi bộ sáu phút, thường có một đánh giá chính thức hơn về tình trạng suy nhược, tập trung vào dự trữ thể chất và phản ứng dự kiến trước các tác nhân gây căng thẳng. Suy nhược có liên quan đến kết quả kém sau ghép phổi, và suy nhược thường liên quan đến thành phần cơ thể. Các phương pháp tính toán béo phì và thành phần cơ thể tiếp tục phát triển, ít tập trung vào BMI mà tập trung nhiều hơn vào hàm lượng mỡ và khối lượng cơ. Các công cụ hứa hẹn định lượng tình trạng suy nhược, thiểu năng cơ và khả năng phục hồi đang được phát triển để dự đoán tốt hơn khả năng phục hồi sau ghép phổi. Với phục hồi chức năng phổi trước phẫu thuật, có thể điều chỉnh thành phần cơ thể và tình trạng suy nhược, từ đó cải thiện kết quả.
Trong trường hợp bệnh nặng cấp tính, việc xác định mức độ suy nhược và khả năng phục hồi đặc biệt khó khăn. Ghép tạng ở bệnh nhân thở máy trước đây rất hiếm, nhưng hiện nay đang trở nên phổ biến hơn. Ngoài ra, việc sử dụng hỗ trợ sự sống ngoài cơ thể như một phương pháp điều trị chuyển tiếp trước ghép tạng đã gia tăng trong những năm gần đây. Những tiến bộ trong công nghệ và khả năng tiếp cận mạch máu đã giúp những bệnh nhân được lựa chọn kỹ lưỡng và tỉnh táo đang trải qua hỗ trợ sự sống ngoài cơ thể có thể tham gia vào các thủ tục đồng ý tham gia và phục hồi chức năng vật lý, đồng thời đạt được kết quả sau ghép tạng tương tự như những bệnh nhân không cần hỗ trợ sự sống ngoài cơ thể trước khi ghép tạng.
Bệnh toàn thân đi kèm trước đây được coi là chống chỉ định tuyệt đối, nhưng tác động của nó đối với kết quả sau ghép giờ đây phải được đánh giá cụ thể. Do ức chế miễn dịch liên quan đến ghép làm tăng khả năng tái phát ung thư, các hướng dẫn trước đây về bệnh ác tính có từ trước đã nhấn mạnh yêu cầu bệnh nhân phải không có ung thư trong năm năm trước khi được đưa vào danh sách chờ ghép. Tuy nhiên, khi các liệu pháp điều trị ung thư trở nên hiệu quả hơn, hiện nay khuyến nghị đánh giá khả năng tái phát ung thư trên cơ sở từng bệnh nhân cụ thể. Bệnh tự miễn toàn thân theo truyền thống được coi là chống chỉ định, một quan điểm gây tranh cãi vì bệnh phổi tiến triển có xu hướng hạn chế tuổi thọ của những bệnh nhân này. Các hướng dẫn mới khuyến nghị rằng ghép phổi nên được thực hiện sau khi đánh giá và điều trị bệnh có mục tiêu hơn để giảm các biểu hiện của bệnh có thể ảnh hưởng xấu đến kết quả, chẳng hạn như các vấn đề về thực quản liên quan đến xơ cứng bì.
Kháng thể lưu hành kháng các phân lớp HLA cụ thể có thể khiến một số người nhận tiềm năng bị dị ứng với các cơ quan hiến tặng cụ thể, dẫn đến thời gian chờ đợi lâu hơn, giảm khả năng ghép, thải ghép cấp tính và tăng nguy cơ mắc CLAD. Tuy nhiên, một số ca ghép giữa kháng thể người nhận tiềm năng và loại người hiến tặng đã đạt được kết quả tương tự với các phác đồ giải mẫn cảm trước phẫu thuật, bao gồm trao đổi huyết tương, truyền immunoglobulin tĩnh mạch và liệu pháp kháng tế bào B.
Lựa chọn và ứng dụng phổi của người hiến tặng
Hiến tạng là một hành động vị tha. Việc xin được sự đồng ý của người hiến tặng và tôn trọng quyền tự chủ của họ là những yếu tố đạo đức quan trọng nhất. Phổi của người hiến tặng có thể bị tổn thương do chấn thương ngực, hô hấp nhân tạo (CPR), hít sặc, thuyên tắc phổi, tổn thương hoặc nhiễm trùng liên quan đến máy thở, hoặc tổn thương thần kinh, vì vậy nhiều phổi của người hiến tặng không phù hợp để cấy ghép. ISHLT (Hiệp hội Ghép tim và Phổi Quốc tế)
Ghép phổi xác định các tiêu chuẩn hiến tặng được chấp nhận chung, khác nhau tùy theo trung tâm ghép tạng. Trên thực tế, rất ít người hiến tặng đáp ứng các tiêu chuẩn "lý tưởng" để hiến phổi (Hình 2). Việc sử dụng phổi của người hiến tặng ngày càng tăng đã đạt được thông qua việc nới lỏng các tiêu chuẩn hiến tặng (tức là những người hiến tặng không đáp ứng các tiêu chuẩn lý tưởng thông thường), đánh giá cẩn thận, chăm sóc người hiến tặng tích cực và đánh giá trong ống nghiệm (Hình 2). Tiền sử hút thuốc lá chủ động của người hiến tặng là một yếu tố nguy cơ gây rối loạn chức năng ghép nguyên phát ở người nhận, nhưng nguy cơ tử vong do sử dụng các cơ quan như vậy là hạn chế và nên được cân nhắc so với hậu quả tử vong do phải chờ đợi lâu để có được phổi hiến tặng từ người chưa bao giờ hút thuốc. Việc sử dụng phổi từ những người hiến tặng lớn tuổi (trên 70 tuổi) đã được lựa chọn nghiêm ngặt và không có yếu tố nguy cơ nào khác có thể đạt được kết quả sống sót và chức năng phổi tương tự như từ những người hiến tặng trẻ tuổi.
Việc chăm sóc đúng cách cho nhiều người hiến tặng nội tạng và cân nhắc khả năng hiến tặng phổi là điều cần thiết để đảm bảo phổi của người hiến tặng có khả năng cao phù hợp để ghép. Mặc dù hiện nay rất ít phổi được cung cấp đáp ứng định nghĩa truyền thống về phổi hiến tặng lý tưởng, nhưng việc nới lỏng các tiêu chí vượt ra ngoài các tiêu chí truyền thống này có thể dẫn đến việc sử dụng thành công các cơ quan mà không ảnh hưởng đến kết quả. Các phương pháp bảo quản phổi tiêu chuẩn giúp bảo vệ tính toàn vẹn của cơ quan trước khi cấy ghép vào người nhận. Các cơ quan có thể được vận chuyển đến cơ sở ghép tạng trong các điều kiện khác nhau, chẳng hạn như bảo quản đông lạnh hoặc tưới máu cơ học ở nhiệt độ hạ thân nhiệt hoặc nhiệt độ cơ thể bình thường. Phổi không được coi là phù hợp để ghép ngay lập tức có thể được đánh giá khách quan hơn và có thể được điều trị bằng tưới máu phổi trong ống nghiệm (EVLP) hoặc bảo quản trong thời gian dài hơn để khắc phục các rào cản về mặt tổ chức đối với việc ghép tạng. Loại hình ghép phổi, quy trình và hỗ trợ trong phẫu thuật đều phụ thuộc vào nhu cầu của bệnh nhân, kinh nghiệm và sở thích của bác sĩ phẫu thuật. Đối với những người có khả năng được ghép phổi mà bệnh tình trở nặng đáng kể trong khi chờ ghép, hỗ trợ sự sống ngoài cơ thể có thể được xem xét như một phương pháp điều trị chuyển tiếp trước khi ghép. Các biến chứng sớm sau phẫu thuật có thể bao gồm chảy máu, tắc nghẽn đường thở hoặc nối mạch máu, và nhiễm trùng vết thương. Tổn thương dây thần kinh hoành hoặc dây thần kinh phế vị ở ngực có thể dẫn đến các biến chứng khác, ảnh hưởng đến chức năng cơ hoành và quá trình làm rỗng dạ dày. Phổi của người hiến tặng có thể bị tổn thương phổi cấp tính sớm sau khi cấy ghép và tái tưới máu, tức là rối loạn chức năng ghép nguyên phát. Việc phân loại và điều trị mức độ nghiêm trọng của rối loạn chức năng ghép nguyên phát là rất có ý nghĩa, vì nó liên quan đến nguy cơ tử vong sớm cao. Do tổn thương phổi tiềm ẩn ở người hiến tặng xảy ra trong vòng vài giờ sau chấn thương não ban đầu, việc quản lý phổi nên bao gồm thông khí thích hợp, tái giãn nở phế nang, nội soi phế quản, hút và rửa (để lấy mẫu nuôi cấy), quản lý dịch bệnh nhân và điều chỉnh tư thế ngực. ABO là viết tắt của nhóm máu A, B, AB và O, CVP là viết tắt của áp lực tĩnh mạch trung tâm, DCD là viết tắt của người hiến tặng phổi từ tử vong do tim, ECMO là viết tắt của oxy hóa màng ngoài cơ thể, EVLW là viết tắt của nước phổi ngoài mạch máu, PaO2/FiO2 là viết tắt của tỷ lệ áp lực oxy một phần động mạch so với nồng độ oxy hít vào, và PEEP là viết tắt của áp lực dương cuối thì thở ra. PiCCO biểu thị đầu ra tim của dạng sóng chỉ số mạch.
Ở một số quốc gia, việc sử dụng phổi hiến tặng có kiểm soát (DCD) đã tăng lên 30-40% ở những bệnh nhân tử vong do tim, và tỷ lệ đào thải cơ quan cấp tính, CLAD và tỷ lệ sống sót tương tự đã đạt được. Theo truyền thống, các cơ quan từ người hiến tặng bị nhiễm virus truyền nhiễm nên được tránh ghép cho người nhận không bị nhiễm bệnh; Tuy nhiên, trong những năm gần đây, các loại thuốc kháng vi-rút tác động trực tiếp lên vi-rút viêm gan C (HCV) đã cho phép ghép phổi của người hiến tặng dương tính với HCV một cách an toàn vào người nhận âm tính với HCV. Tương tự như vậy, phổi của người hiến tặng dương tính với vi-rút gây suy giảm miễn dịch ở người (HIV) có thể được ghép vào người nhận dương tính với HIV, và phổi của người hiến tặng dương tính với vi-rút viêm gan B (HBV) có thể được ghép vào người nhận đã được tiêm vắc-xin phòng HBV và những người có miễn dịch. Đã có báo cáo về việc ghép phổi từ người hiến tặng đang hoạt động hoặc đã từng nhiễm SARS-CoV-2. Chúng ta cần thêm bằng chứng để xác định tính an toàn của việc lây nhiễm vi-rút truyền nhiễm vào phổi của người hiến tặng để ghép.
Do tính phức tạp của việc lấy nhiều cơ quan, việc đánh giá chất lượng phổi của người hiến tặng là một thách thức. Sử dụng hệ thống tưới máu phổi trong ống nghiệm để đánh giá cho phép đánh giá chi tiết hơn về chức năng phổi của người hiến tặng và khả năng phục hồi trước khi sử dụng (Hình 2). Vì phổi của người hiến tặng rất dễ bị tổn thương, hệ thống tưới máu phổi trong ống nghiệm cung cấp một nền tảng để thực hiện các liệu pháp sinh học cụ thể nhằm phục hồi phổi bị tổn thương của người hiến tặng (Hình 2). Hai thử nghiệm ngẫu nhiên đã chỉ ra rằng việc tưới máu phổi ở nhiệt độ cơ thể bình thường trong ống nghiệm của phổi của người hiến tặng đáp ứng các tiêu chí thông thường là an toàn và nhóm ghép tạng có thể kéo dài thời gian bảo quản theo cách này. Bảo quản phổi của người hiến tặng ở nhiệt độ hạ thân nhiệt cao hơn (6 đến 10°C) thay vì 0 đến 4°C trong đá đã được báo cáo là cải thiện sức khỏe ty thể, giảm tổn thương và cải thiện chức năng phổi. Đối với các ca ghép trong ngày bán chọn lọc, việc bảo quản qua đêm lâu hơn đã được báo cáo là đạt được kết quả tốt sau ghép. Một thử nghiệm an toàn không kém hơn quy mô lớn đang được tiến hành, so sánh bảo quản ở 10°C với bảo quản đông lạnh tiêu chuẩn (số đăng ký NCT05898776 tại ClinicalTrials.gov). Mọi người ngày càng ủng hộ việc phục hồi nội tạng kịp thời thông qua các trung tâm chăm sóc người hiến tặng đa tạng và cải thiện chức năng nội tạng thông qua các trung tâm sửa chữa nội tạng, để các nội tạng chất lượng tốt hơn có thể được sử dụng cho việc cấy ghép. Tác động của những thay đổi này đối với hệ sinh thái cấy ghép vẫn đang được đánh giá.
Để bảo tồn các cơ quan DCD có thể kiểm soát được, việc tưới máu tại chỗ ở nhiệt độ cơ thể bình thường thông qua trao đổi oxy qua màng ngoài cơ thể (ECMO) có thể được sử dụng để đánh giá chức năng của các cơ quan bụng và hỗ trợ việc tiếp nhận và bảo tồn trực tiếp các cơ quan ngực, bao gồm cả phổi. Kinh nghiệm về ghép phổi sau khi tưới máu tại chỗ ở nhiệt độ cơ thể bình thường ở ngực và bụng còn hạn chế và kết quả còn chưa rõ ràng. Có những lo ngại rằng quy trình này có thể gây tổn thương cho người hiến tặng đã chết và vi phạm các nguyên tắc đạo đức cơ bản của việc thu hoạch nội tạng; do đó, việc tưới máu tại chỗ ở nhiệt độ cơ thể bình thường vẫn chưa được phép ở nhiều quốc gia.
Bệnh ung thư
Tỷ lệ mắc ung thư trong quần thể sau ghép phổi cao hơn so với quần thể nói chung và tiên lượng có xu hướng kém, chiếm 17% số ca tử vong. Ung thư phổi và bệnh tăng sinh lympho sau ghép (PTLD) là những nguyên nhân phổ biến nhất gây tử vong liên quan đến ung thư. Ức chế miễn dịch lâu dài, ảnh hưởng của việc hút thuốc trước đó hoặc nguy cơ mắc bệnh phổi tiềm ẩn đều dẫn đến nguy cơ phát triển ung thư phổi ở phổi của chính người nhận phổi, nhưng trong một số ít trường hợp, ung thư phổi cận lâm sàng do người hiến tặng truyền cũng có thể xảy ra ở phổi được ghép. Ung thư da không phải u hắc tố là loại ung thư phổ biến nhất ở những người được ghép, vì vậy việc theo dõi ung thư da thường xuyên là điều cần thiết. PTLD tế bào B do vi-rút Epstein-Barr gây ra là một nguyên nhân quan trọng gây bệnh và tử vong. Mặc dù PTLD có thể khỏi bằng cách ức chế miễn dịch tối thiểu, nhưng liệu pháp nhắm mục tiêu tế bào B bằng rituximab, hóa trị liệu toàn thân hoặc cả hai thường là bắt buộc.
Sự sống còn và kết quả lâu dài
Tỷ lệ sống sót sau ghép phổi vẫn còn hạn chế so với các ca ghép tạng khác, với thời gian trung bình là 6,7 năm và ít tiến triển trong kết quả lâu dài của bệnh nhân trong ba thập kỷ. Tuy nhiên, nhiều bệnh nhân đã có những cải thiện đáng kể về chất lượng cuộc sống, tình trạng thể chất và các kết quả khác do bệnh nhân báo cáo; Để tiến hành đánh giá toàn diện hơn về hiệu quả điều trị của ghép phổi, cần phải chú ý nhiều hơn đến các kết quả do những bệnh nhân này báo cáo. Một nhu cầu lâm sàng quan trọng chưa được đáp ứng là giải quyết tình trạng tử vong của người nhận do các biến chứng tử vong do suy ghép muộn hoặc ức chế miễn dịch kéo dài. Đối với những người nhận ghép phổi, cần phải chăm sóc tích cực lâu dài, điều này đòi hỏi sự phối hợp để bảo vệ sức khỏe tổng thể của người nhận bằng cách theo dõi và duy trì chức năng ghép một mặt, giảm thiểu các tác dụng phụ của ức chế miễn dịch và hỗ trợ sức khỏe thể chất và tinh thần của người nhận mặt khác (Hình 1).
Hướng đi tương lai
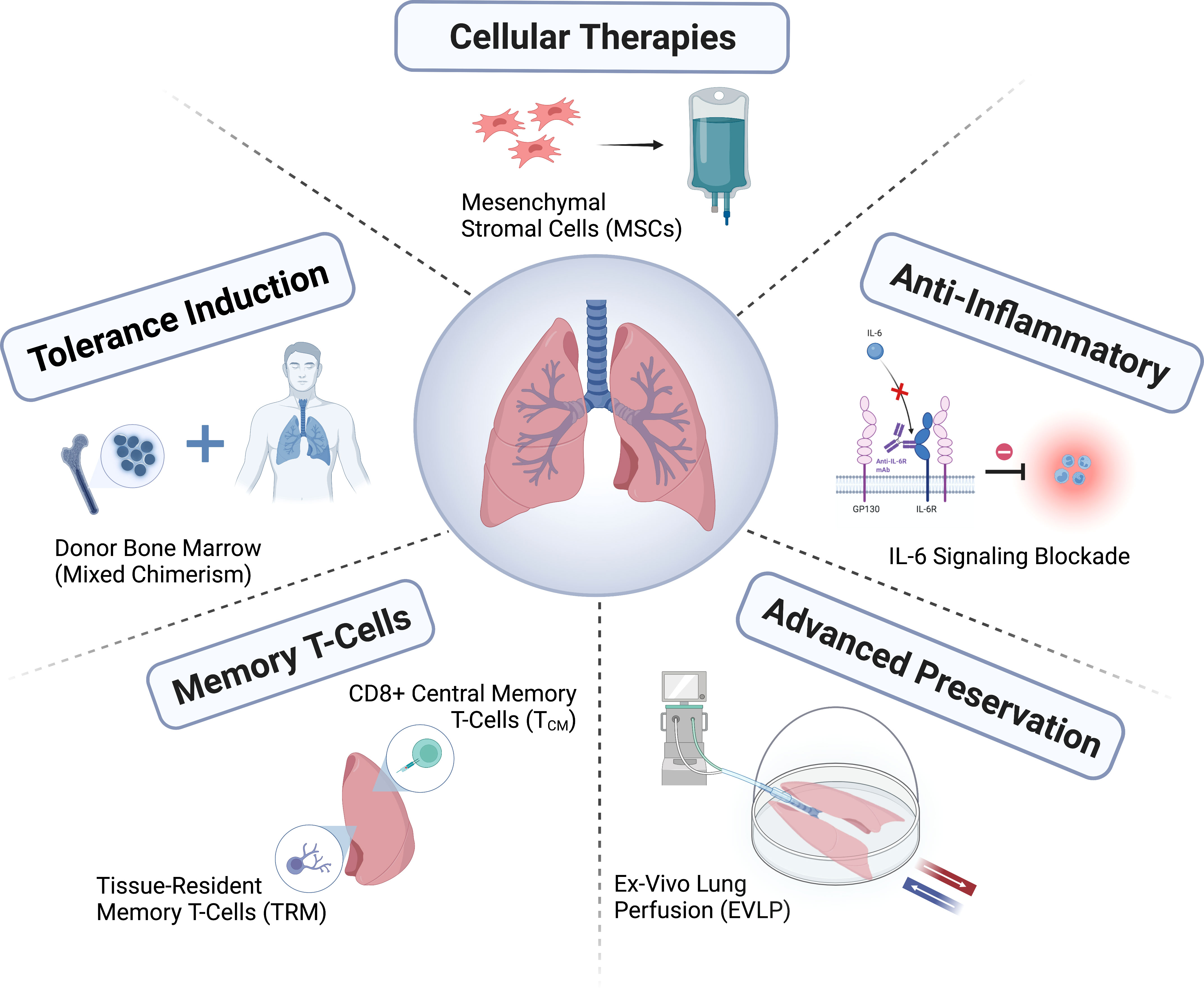
Ghép phổi là một phương pháp điều trị đã đạt được nhiều tiến bộ trong một thời gian ngắn, nhưng vẫn chưa đạt được tiềm năng đầy đủ. Tình trạng thiếu hụt phổi hiến tặng phù hợp vẫn là một thách thức lớn, và các phương pháp mới để đánh giá và chăm sóc người hiến tặng, điều trị và sửa chữa phổi hiến tặng, cũng như cải thiện việc bảo quản người hiến tặng vẫn đang được phát triển. Cần phải cải thiện các chính sách phân bổ nội tạng bằng cách cải thiện sự phù hợp giữa người hiến tặng và người nhận để tăng thêm lợi ích ròng. Ngày càng có nhiều sự quan tâm đến việc chẩn đoán tình trạng đào thải hoặc nhiễm trùng thông qua chẩn đoán phân tử, đặc biệt là với DNA tự do có nguồn gốc từ người hiến tặng, hoặc trong việc hướng dẫn giảm thiểu ức chế miễn dịch; Tuy nhiên, tính hữu ích của các chẩn đoán này như một phương pháp bổ trợ cho các phương pháp theo dõi ghép lâm sàng hiện tại vẫn chưa được xác định.
Lĩnh vực ghép phổi đã phát triển thông qua việc thành lập các tập đoàn (ví dụ: số đăng ký ClinicalTrials.gov NCT04787822; https://lungtransplantconsortium.org) để cùng nhau hợp tác, giúp phòng ngừa và điều trị rối loạn chức năng ghép nguyên phát, dự báo CLAD, chẩn đoán sớm và các điểm nội tại (endotyping), tinh chỉnh hội chứng. Nghiên cứu về rối loạn chức năng ghép nguyên phát, thải ghép qua trung gian kháng thể, ALAD và cơ chế CLAD đã đạt được tiến bộ nhanh hơn. Việc giảm thiểu tác dụng phụ và giảm nguy cơ mắc ALAD và CLAD thông qua liệu pháp ức chế miễn dịch cá nhân hóa, cũng như xác định các kết quả lấy bệnh nhân làm trung tâm và kết hợp chúng vào các biện pháp đánh giá kết quả, sẽ là chìa khóa để cải thiện thành công lâu dài của ghép phổi.
Thời gian đăng: 23-11-2024