Suy mòn (Cachexia) là một bệnh lý toàn thân đặc trưng bởi tình trạng sụt cân, teo cơ và mô mỡ, và viêm toàn thân. Suy mòn là một trong những biến chứng chính và nguyên nhân gây tử vong ở bệnh nhân ung thư. Ngoài ung thư, suy mòn có thể do nhiều bệnh lý mạn tính không ác tính gây ra, bao gồm suy tim, suy thận, bệnh phổi tắc nghẽn mạn tính, bệnh lý thần kinh, AIDS và viêm khớp dạng thấp. Tỷ lệ mắc suy mòn ở bệnh nhân ung thư ước tính từ 25% đến 70%, ảnh hưởng nghiêm trọng đến chất lượng cuộc sống (QOL) của bệnh nhân và làm trầm trọng thêm độc tính liên quan đến điều trị.
Việc can thiệp hiệu quả vào chứng suy mòn có ý nghĩa to lớn trong việc cải thiện chất lượng cuộc sống và tiên lượng bệnh nhân ung thư. Tuy nhiên, mặc dù đã có một số tiến bộ trong nghiên cứu về cơ chế bệnh sinh của chứng suy mòn, nhiều loại thuốc được phát triển dựa trên các cơ chế tiềm ẩn chỉ có hiệu quả một phần hoặc không hiệu quả. Hiện tại, chưa có phương pháp điều trị hiệu quả nào được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt.
Có nhiều lý do dẫn đến thất bại của các thử nghiệm lâm sàng về chứng suy mòn, và nguyên nhân cơ bản có thể nằm ở việc thiếu hiểu biết sâu sắc về cơ chế và diễn biến tự nhiên của chứng suy mòn. Gần đây, Giáo sư Xiao Ruiping và nhà nghiên cứu Hu Xinli từ Viện Công nghệ Tương lai, Đại học Bắc Kinh đã cùng nhau công bố một bài báo trên tạp chí Nature Metabolism, hé lộ vai trò quan trọng của con đường lactic-GPR81 trong sự xuất hiện của chứng suy mòn do ung thư, đồng thời đưa ra một ý tưởng mới cho việc điều trị chứng suy mòn. Chúng tôi tóm tắt nội dung này bằng cách tổng hợp các bài báo từ Nat Metab, Science, Nat Rev Clin Oncol và các tạp chí khác.
Sụt cân thường do giảm lượng thức ăn nạp vào và/hoặc tăng tiêu hao năng lượng. Các nghiên cứu trước đây cho thấy những thay đổi sinh lý này trong chứng suy mòn liên quan đến khối u được thúc đẩy bởi một số cytokine nhất định do vi môi trường khối u tiết ra. Ví dụ, các yếu tố như yếu tố biệt hóa tăng trưởng 15 (GDF15), lipocalin-2 và protein giống insulin 3 (INSL3) có thể ức chế lượng thức ăn nạp vào bằng cách liên kết với các vị trí điều hòa cảm giác thèm ăn trong hệ thần kinh trung ương, dẫn đến chán ăn ở bệnh nhân. IL-6, PTHrP, activin A và các yếu tố khác thúc đẩy sụt cân và teo mô bằng cách kích hoạt con đường dị hóa và tăng tiêu hao năng lượng. Hiện nay, nghiên cứu về cơ chế của chứng suy mòn chủ yếu tập trung vào các protein tiết ra này, và rất ít nghiên cứu đề cập đến mối liên quan giữa các chất chuyển hóa của khối u và chứng suy mòn. Giáo sư Xiao Ruiping và nhà nghiên cứu Hu Xinli đã áp dụng một phương pháp tiếp cận mới để khám phá cơ chế quan trọng của chứng suy mòn liên quan đến khối u từ góc độ các chất chuyển hóa của khối u.
Đầu tiên, nhóm của Giáo sư Xiao Ruiping đã sàng lọc hàng ngàn chất chuyển hóa trong máu của nhóm đối chứng khỏe mạnh và mô hình chuột mắc chứng suy mòn do ung thư phổi, và phát hiện ra rằng axit lactic là chất chuyển hóa tăng cao nhất ở chuột mắc chứng suy mòn. Nồng độ axit lactic trong huyết thanh tăng theo sự phát triển của khối u và cho thấy mối tương quan mạnh mẽ với sự thay đổi cân nặng của chuột mang khối u. Các mẫu huyết thanh thu thập từ bệnh nhân ung thư phổi xác nhận rằng axit lactic cũng đóng vai trò quan trọng trong sự tiến triển của chứng suy mòn do ung thư ở người.
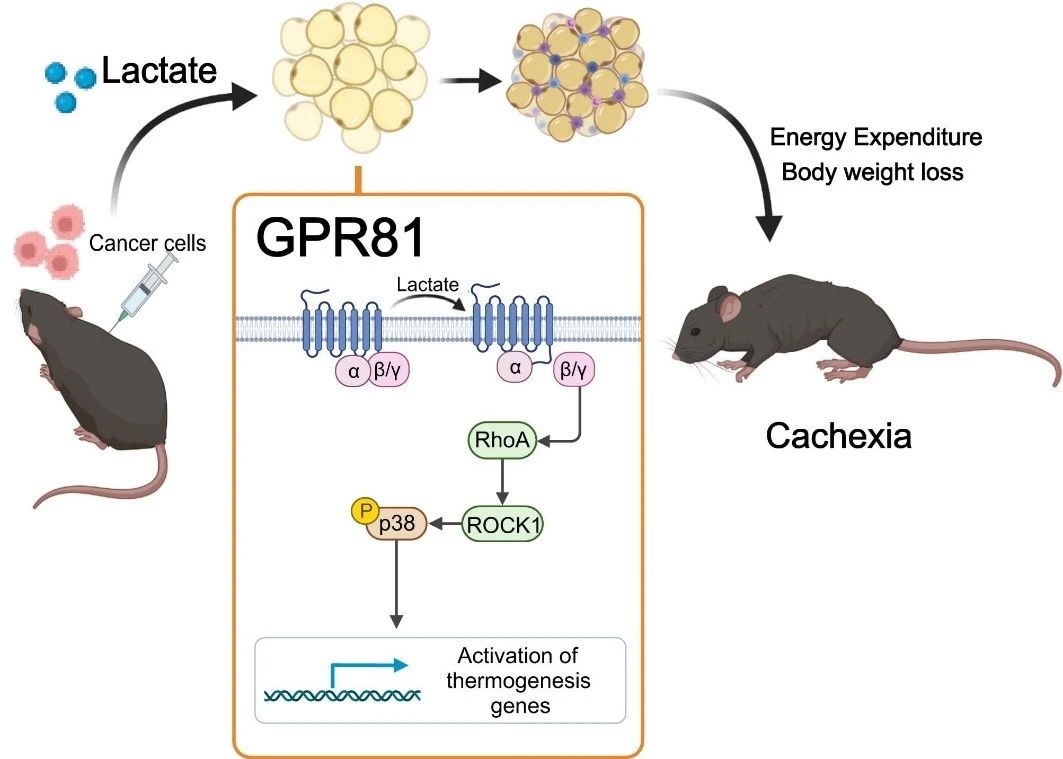
Để xác định liệu nồng độ axit lactic cao có gây ra chứng suy mòn hay không, nhóm nghiên cứu đã đưa axit lactic vào máu của những con chuột khỏe mạnh thông qua một bơm thẩm thấu được cấy dưới da, làm tăng nồng độ axit lactic trong huyết thanh một cách nhân tạo lên mức tương đương với những con chuột bị suy mòn. Sau 2 tuần, những con chuột này phát triển một kiểu hình điển hình của chứng suy mòn, chẳng hạn như sụt cân, teo mỡ và teo cơ. Những kết quả này cho thấy quá trình tái cấu trúc mỡ do lactate gây ra tương tự như quá trình do tế bào ung thư gây ra. Lactate không chỉ là một chất chuyển hóa đặc trưng của chứng suy mòn do ung thư mà còn là một chất trung gian chính của kiểu hình tăng dị hóa do ung thư gây ra.
Tiếp theo, họ phát hiện ra rằng việc xóa thụ thể lactate GPR81 có hiệu quả trong việc làm giảm các biểu hiện suy mòn do khối u và huyết thanh gây ra mà không ảnh hưởng đến nồng độ lactate huyết thanh. Vì GPR81 được biểu hiện nhiều trong mô mỡ và những thay đổi trong mô mỡ xảy ra sớm hơn cơ xương trong quá trình phát triển suy mòn, nên hiệu ứng loại bỏ gen đặc hiệu của GPR81 trong mô mỡ chuột tương tự như hiệu ứng loại bỏ gen toàn thân, giúp cải thiện tình trạng giảm cân do khối u gây ra và tiêu thụ mỡ và cơ xương. Điều này cho thấy GPR81 trong mô mỡ là cần thiết cho sự phát triển suy mòn do ung thư do axit lactic gây ra.
Các nghiên cứu sâu hơn đã xác nhận rằng sau khi liên kết với GPR81, các phân tử axit lactic thúc đẩy quá trình Browning chất béo, phân giải lipid và tăng sản xuất nhiệt toàn thân thông qua con đường truyền tín hiệu Gβγ-RhoA/ROCK1-p38, thay vì con đường PKA cổ điển.
Mặc dù có những kết quả đầy hứa hẹn về cơ chế bệnh sinh của chứng suy mòn liên quan đến ung thư, những phát hiện này vẫn chưa được chuyển thành các phương pháp điều trị hiệu quả, vì vậy hiện tại chưa có tiêu chuẩn điều trị nào cho những bệnh nhân này. Tuy nhiên, một số hiệp hội, chẳng hạn như ESMO và Hiệp hội Dinh dưỡng Lâm sàng và Chuyển hóa Châu Âu, đã xây dựng các hướng dẫn lâm sàng. Hiện nay, các hướng dẫn quốc tế khuyến nghị mạnh mẽ việc thúc đẩy quá trình trao đổi chất và giảm dị hóa thông qua các phương pháp như dinh dưỡng, tập thể dục và dùng thuốc.
Thời gian đăng: 28-04-2024